MIT Mirai: robusti strumenti di intelligenza artificiale per predire il cancro futuro
I ricercatori hanno creato un algoritmo di valutazione del rischio che mostra prestazioni coerenti tra i set di dati di Stati Uniti, Europa e Asia.
Per contrarre il cancro prima, dobbiamo prevedere chi lo contrarrà in futuro. La natura complessa della previsione del rischio è stata rafforzata dagli strumenti di intelligenza artificiale (AI), ma l’adozione dell’IA in medicina è stata limitata dalle scarse prestazioni su nuove popolazioni di pazienti e dall’incuria verso le minoranze razziali.
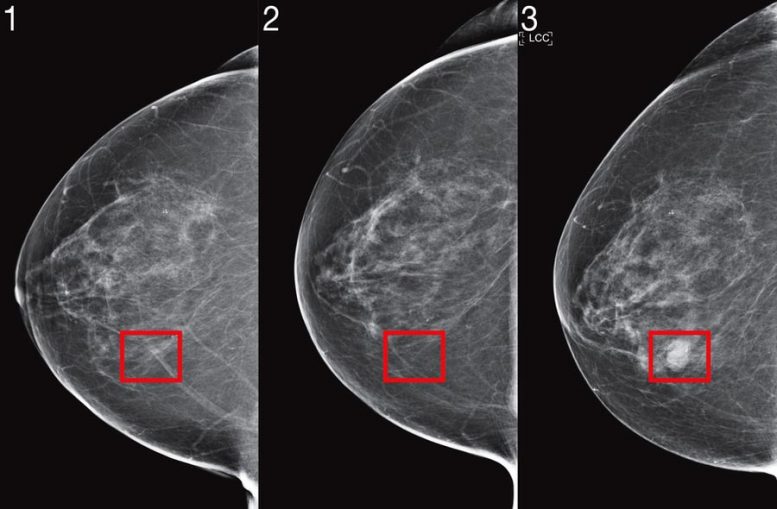
Due anni fa, un team di scienziati del MIT Science s’Computer e Intelligence Laboratory Artificiale (CSAIL) e Jameel Clinic (J-Clinic) ha dimostrato un sistema di apprendimento profondo per predire il rischio di cancro utilizzando mammografia solo un paziente. Il modello ha mostrato una promessa significativa e persino una migliore inclusività: era ugualmente accurato sia per le donne bianche che per quelle nere, il che è particolarmente importante dato che le donne nere hanno il 43% in più di probabilità di morire di cancro al seno.
Ma per integrare i modelli di rischio basati su immagini nelle cure cliniche e renderli ampiamente disponibili, i ricercatori affermano che i modelli necessitavano sia di miglioramenti algoritmici che di convalida su larga scala in diversi ospedali per dimostrare la loro robustezza.
A tal fine, hanno adattato il loro nuovo algoritmo “Mirai” per catturare i requisiti unici della modellazione del rischio. Mirai modella congiuntamente il rischio di un paziente su più punti temporali futuri e può opzionalmente beneficiare di fattori di rischio clinici come l’età o la storia familiare, se disponibili. L’algoritmo è progettato anche per produrre previsioni coerenti con variazioni minori negli ambienti clinici, come la scelta della macchina per mammografia.
Potrebbero essere utilizzati strumenti di intelligenza artificiale robusti per prevedere il futuro cancro al seno.
Il team ha addestrato Mirai sullo stesso set di dati di oltre 200.000 esami del Massachusetts General Hospital (MGH) dal loro lavoro precedente e lo ha convalidato su set di test da MGH, il Karolinska Institute in Svezia e Chang Gung Memorial Hospital a Taiwan. Mirai è ora installato presso MGH ei collaboratori del team stanno lavorando attivamente per integrare il modello nella cura.
Mirai è stato significativamente più accurato dei metodi precedenti nella previsione del rischio di cancro e nell’identificazione dei gruppi ad alto rischio in tutti e tre i set di dati. Confrontando coorti ad alto rischio sul set di test MGH, il team ha scoperto che il loro modello ha identificato quasi due volte più diagnosi di cancro future rispetto all’attuale standard clinico, il modello Tyrer-Cuzick. Mirai era altrettanto accurato nei pazienti di diverse razze, gruppi di età e categorie di densità mammaria nel set di test MGH e in diversi sottotipi di cancro nel set di test Karolinska.
“Modelli di rischio di cancro al seno migliorati consentono strategie di screening mirate che consentono un rilevamento precoce e meno danni allo screening rispetto alle linee guida esistenti”, afferma Adam Yala, dottorando CSAIL e autore principale di un articolo su Mirai pubblicato la scorsa settimana su Science Translational Medicine . “Il nostro obiettivo è rendere questi progressi parte dello standard di cura. Stiamo collaborando con i medici di Novant Health in North Carolina, Emory in Georgia, Maccabi in Israele, TecSalud in Messico, Apollo in India e Barretos in Brasile per convalidare ulteriormente il modello su popolazioni diverse e studiare come implementarlo clinicamente al meglio “.
Come funziona
Nonostante l’ampia adozione dello screening del cancro al seno, i ricercatori affermano che la pratica è piena di controversie: strategie di screening più aggressive mirano a massimizzare i benefici della diagnosi precoce, mentre gli screening meno frequenti mirano a ridurre i falsi positivi, l’ansia e i costi per quelli che non svilupperà mai il cancro al seno.
Le attuali linee guida cliniche utilizzano modelli di rischio per determinare quali pazienti dovrebbero essere raccomandati per l’imaging supplementare e la risonanza magnetica. Alcune linee guida utilizzano modelli di rischio con la giusta età per determinare se e con quale frequenza una donna dovrebbe essere sottoposta a screening; altri combinano più fattori correlati all’età, agli ormoni, alla genetica e alla densità del seno per determinare ulteriori test. Nonostante decenni di sforzi, l’ accuratezza dei modelli di rischio utilizzati nella pratica clinica rimane modesta.
Recentemente, i modelli di rischio basati sulla mammografia ad apprendimento profondo hanno mostrato prestazioni promettenti. Per portare questa tecnologia nella clinica, il team ha identificato tre innovazioni che ritengono fondamentali per la modellazione del rischio: tempo di modellazione congiunta, uso facoltativo di fattori di rischio non di immagine e metodi per garantire prestazioni coerenti in tutti i contesti clinici.
1 volta
Inerente alla modellazione del rischio è l’apprendimento da pazienti con diverse quantità di follow-up e la valutazione del rischio in momenti diversi: questo può determinare la frequenza con cui vengono sottoposti a screening, se devono avere immagini supplementari o anche prendere in considerazione trattamenti preventivi.
Sebbene sia possibile addestrare modelli separati per valutare il rischio per ogni punto temporale, questo approccio può portare a valutazioni del rischio che non hanno senso, come prevedere che un paziente ha un rischio più elevato di sviluppare il cancro entro due anni rispetto a quanto avviene entro cinque anni . Per risolvere questo problema, il team ha progettato il proprio modello per prevedere il rischio in tutti i momenti contemporaneamente, utilizzando uno strumento chiamato “livello di rischio additivo”.
Lo strato di rischio additivo funziona come segue: La loro rete prevede il rischio di un paziente in un momento, come cinque anni, come un’estensione del rischio nel punto temporale precedente, come quattro anni. In tal modo, il loro modello può apprendere dai dati con quantità variabili di follow-up e quindi produrre valutazioni del rischio auto-coerenti.
- Fattori di rischio diversi dall’immagine
Sebbene questo metodo si concentri principalmente sulle mammografie, il team ha voluto utilizzare anche fattori di rischio diversi dall’immagine come l’età e fattori ormonali, se disponibili, ma non richiederli al momento del test. Un approccio potrebbe essere quello di aggiungere questi fattori come input al modello con l’immagine, ma questo progetto impedirebbe alla maggior parte degli ospedali (come Karolinska e CGMH), che non dispongono di questa infrastruttura, di utilizzare il modello.
Affinché Mirai possa trarre vantaggio dai fattori di rischio senza richiederli, la rete prevede tali informazioni al momento dell’addestramento e, se non sono presenti, può utilizzare la propria versione predittiva. Le mammografie sono ricche fonti di informazioni sulla salute e così tanti fattori di rischio tradizionali come l’età e lo stato della menopausa possono essere facilmente previsti dalla loro imaging. Come risultato di questo progetto, lo stesso modello potrebbe essere utilizzato da qualsiasi clinica a livello globale e, se dispongono di tali informazioni aggiuntive, possono utilizzarle.
- Prestazioni costanti in tutti gli ambienti clinici
Per incorporare modelli di rischio di apprendimento profondo nelle linee guida cliniche, i modelli devono funzionare in modo coerente in diversi ambienti clinici e le sue previsioni non possono essere influenzate da variazioni minori come la macchina su cui è stata adottata la mammografia. Anche in un singolo ospedale, gli scienziati hanno scoperto che la formazione standard non produceva previsioni coerenti prima e dopo un cambiamento nelle macchine mammografiche, poiché l’algoritmo poteva imparare a fare affidamento su diversi segnali specifici per l’ambiente. Per de-bias il modello, il team ha utilizzato uno schema contraddittorio in cui il modello apprende specificamente rappresentazioni mammografiche invarianti rispetto all’ambiente clinico di origine, per produrre previsioni coerenti.
Per testare ulteriormente questi aggiornamenti in diversi contesti clinici, gli scienziati hanno valutato Mirai su nuovi set di test di Karolinska in Svezia e Chang Gung Memorial Hospital di Taiwan e hanno scoperto che ha ottenuto prestazioni costanti. Il team ha anche analizzato le prestazioni del modello tra razze, età e categorie di densità del seno nel set di test MGH e tra i sottotipi di cancro sul set di dati Karolinska e ha scoperto che si comportava in modo simile in tutti i sottogruppi.
“Le donne afro-americane continuano a presentare il cancro al seno in giovane età, e spesso in fasi successive”, dice Salewai Oseni, un chirurgo della mammella presso il Massachusetts General Hospital che non è stato coinvolto nel lavoro. “Questo, insieme all’istanza più alta di cancro al seno triplo negativo in questo gruppo, ha portato ad un aumento della mortalità per cancro al seno. Questo studio dimostra lo sviluppo di un modello di rischio la cui previsione ha una notevole accuratezza in tutta la razza. L’opportunità per il suo utilizzo clinico è alta. “
Ecco come funziona Mirai:
- L’immagine della mammografia viene trasmessa tramite qualcosa chiamato “codificatore di immagini”.
- Ogni rappresentazione dell’immagine, così come la vista da cui proviene, viene aggregata con altre immagini da altre viste per ottenere una rappresentazione dell’intera mammografia.
- Con la mammografia, i fattori di rischio tradizionali di un paziente vengono previsti utilizzando un modello Tyrer-Cuzick (età, peso, fattori ormonali). Se non disponibile, vengono utilizzati i valori previsti.
- Con queste informazioni, lo strato di rischio aggiuntivo prevede il rischio di un paziente per ogni anno nei prossimi cinque anni.
Migliorare Mirai
Sebbene il modello attuale non prenda in considerazione nessuno dei precedenti risultati di imaging del paziente, i cambiamenti nell’imaging nel tempo contengono una grande quantità di informazioni. In futuro il team mira a creare metodi che possano utilizzare efficacemente l’intera storia di imaging di un paziente.
In modo simile, il team osserva che il modello potrebbe essere ulteriormente migliorato utilizzando la “tomosintesi”, una tecnica a raggi X per lo screening dei pazienti affetti da cancro asintomatico. Oltre a migliorare la precisione, sono necessarie ulteriori ricerche per determinare come adattare i modelli di rischio basati su immagini a diversi dispositivi mammografici con dati limitati.
“Sappiamo che la risonanza magnetica può rilevare i tumori prima della mammografia e che un rilevamento precoce migliora i risultati dei pazienti”, afferma Yala. “Ma per i pazienti a basso rischio di cancro, il rischio di falsi positivi può superare i benefici. Con modelli di rischio migliorati, possiamo progettare linee guida di screening del rischio più sfumate che offrono uno screening più sensibile, come la risonanza magnetica, ai pazienti che svilupperanno il cancro, per ottenere risultati migliori riducendo al contempo lo screening non necessario e il trattamento eccessivo per il resto “.
“Siamo entrambi entusiasti e onorati di porre la domanda se questo sistema di intelligenza artificiale funzionerà per le popolazioni afro-americane”, afferma Judy Gichoya, MD, MS e assistente professore di radiologia interventistica e informatica presso la Emory University, che non era coinvolta con il opera. “Stiamo studiando approfonditamente questa domanda e come rilevare il fallimento.”
Riferimento: “Verso modelli robusti basati sulla mammografia per il rischio di cancro al seno” di Adam Yala, Peter G. Mikhael, Fredrik Strand, Gigin Lin, Kevin Smith, Yung-Liang Wan, Leslie Lamb, Kevin Hughes, Constance Lehman e Regina Barzilay, 27 Gennaio 2021, Science Translational Medicine .
DOI: 10.1126 / scitranslmed.aba4373
Yala ha scritto l’articolo su Mirai insieme allo specialista di ricerca del MIT Peter G. Mikhael, il radiologo Fredrik Strand del Karolinska University Hospital, Gigin Lin del Chang Gung Memorial Hospital, il professore associato Kevin Smith del KTH Royal Institute of Technology, il professor Yung-Liang Wan di Chang Gung Università, Leslie Lamb di MGH, Kevin Hughes di MGH, autore senior e professoressa della Harvard Medical School Constance Lehman di MGH e autore senior e professoressa del MIT Regina Barzilay.
Il lavoro è stato sostenuto da sovvenzioni di Susan G Komen, Breast Cancer Research Foundation, Quanta Computing e MIT Jameel Clinic. È stato anche sostenuto da Chang Gung Medical Foundation Grant e da Stockholm Läns Landsting HMT Grant.